Os anticorpos, também chamados de imunoglobulinas (Ig), são glicoproteínas que se ligam especificamente a antígenos.
A preparação de anticorpo convencional é produzida por imunização de animais e coleta de anti-soro.Portanto, o antissoro geralmente contém anticorpos contra outros antígenos não relacionados e outros componentes proteicos no soro.Moléculas de antígenos gerais contêm principalmente vários epítopos diferentes, portanto, os anticorpos convencionais também são uma mistura de anticorpos contra vários epítopos diferentes.Mesmo os anticorpos séricos convencionais direcionados contra o mesmo epítopo ainda são compostos por anticorpos heterogêneos produzidos por diferentes clones de células B.Portanto, os anticorpos séricos convencionais também são chamados de anticorpos policlonais, ou anticorpos policlonais para abreviar.
O anticorpo monoclonal (anticorpo monoclonal) é um anticorpo altamente uniforme produzido por um único clone de célula B e direcionado apenas contra um epítopo específico.Geralmente é preparado pela tecnologia de hibridoma - a tecnologia de anticorpos de hibridoma é baseada na tecnologia de fusão celular, combinando células B com a capacidade de secretar anticorpos específicos e células de mieloma com capacidade infinita de crescimento em hibridomas de células B.Esta célula de hibridoma tem as características de uma célula parental.Pode proliferar indefinidamente e imortalmente in vitro como células de mieloma, e pode sintetizar e secretar anticorpos específicos como linfócitos esplênicos.Através da clonagem, pode-se obter uma linha monoclonal derivada de uma única célula de hibridoma, ou seja, uma linha celular de hibridoma.Os anticorpos que produz são anticorpos altamente homogêneos contra o mesmo determinante antigênico, ou seja, anticorpos monoclonais.
Os anticorpos existem como um ou mais monômeros em forma de Y (isto é, anticorpos monoclonais ou anticorpos policlonais).Cada monômero em forma de Y é composto por 4 cadeias polipeptídicas, incluindo duas cadeias pesadas idênticas e duas cadeias leves idênticas.Cadeia leve e cadeia pesada são nomeadas de acordo com seu peso molecular.O topo da estrutura em forma de Y é a região variável, que é o sítio de ligação do antígeno.(Trecho do Detai Bio-Monoclonal Antibody Concept)
Estrutura do anticorpo
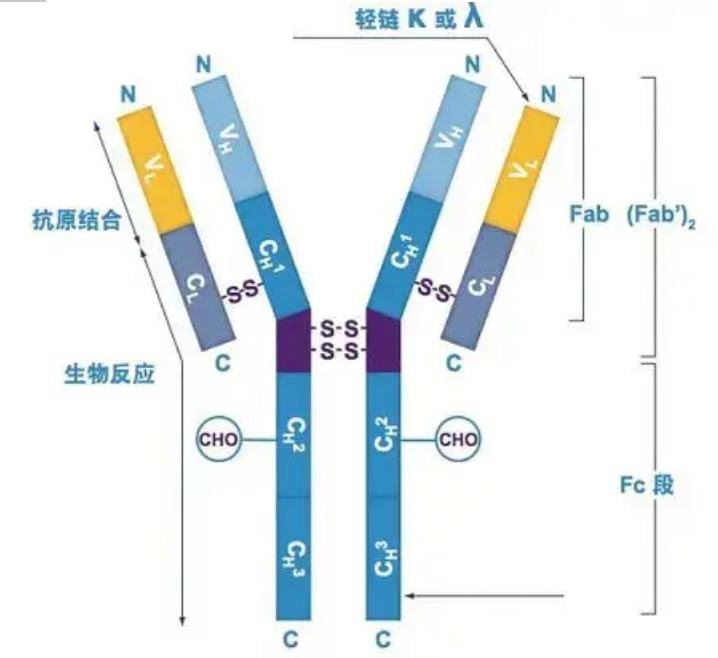 Corrente pesada
Corrente pesada
Existem cinco tipos de cadeias pesadas de Ig de mamíferos, nomeadas com as letras gregas α, δ, ε, γ e μ.Os anticorpos correspondentes são chamados IgA, IgD, IgE, IgG e IgM.Diferentes cadeias pesadas diferem em tamanho e composição.α e γ contêm aproximadamente 450 aminoácidos, enquanto μ e ε contêm aproximadamente 550 aminoácidos.
Cada cadeia pesada tem duas regiões: a região constante e a região variável.Todos os anticorpos do mesmo tipo têm a mesma região constante, mas existem diferenças entre anticorpos de diferentes tipos.As regiões constantes das cadeias pesadas γ, α e δ são compostas por três domínios de Ig em tandem, com uma região de dobradiça para aumentar sua flexibilidade;as regiões constantes das cadeias pesadas μ e ε são compostas por 4 domínios Ig.A região variável da cadeia pesada do anticorpo produzida por diferentes células B é diferente, mas a região variável do anticorpo produzida pela mesma célula B ou clone celular é a mesma, e a região variável de cada cadeia pesada tem cerca de 110 aminoácidos de comprimento., E formam um único domínio Ig.
cadeia leve
Existem apenas dois tipos de cadeias leves em mamíferos: tipo lambda e tipo kappa.Cada cadeia leve tem dois domínios ligados: uma região constante e uma região variável.O comprimento da cadeia leve é de cerca de 211 ~ 217 aminoácidos.As duas cadeias leves contidas em cada anticorpo são sempre as mesmas.Para mamíferos, a cadeia leve de cada anticorpo possui apenas um tipo: kappa ou lambda.Em alguns vertebrados inferiores, como peixes cartilaginosos (peixes cartilaginosos) e peixes ósseos, também são encontrados outros tipos de cadeias leves, como o tipo iota (iota).
Segmentos Fab e Fc
O segmento Fc pode ser combinado diretamente com enzimas ou corantes fluorescentes para marcar os anticorpos.É a parte onde o anticorpo se fixa na placa durante o processo ELISA, e é também a parte onde o segundo anticorpo é reconhecido e ligado em imunoprecipitação, imunoblotting e imuno-histoquímica.Os anticorpos podem ser hidrolisados em dois segmentos F(ab) e um segmento Fc por enzimas proteolíticas, como a papaína, ou podem ser quebrados da região da dobradiça pela pepsina e hidrolisados em um segmento F(ab)2 e um segmento Fc.Fragmentos de anticorpo IgG às vezes são muito úteis.Devido à falta do segmento Fc, o segmento F(ab) não precipitará com o antígeno, nem será capturado por células imunes em estudos in vivo.Devido aos pequenos fragmentos moleculares e à falta de função de reticulação (devido à falta do segmento Fc), o segmento Fab é geralmente usado para radiomarcação em estudos funcionais, e o segmento Fc é usado principalmente como agente bloqueador na coloração histoquímica.
Regiões variáveis e constantes
A região variável (região V) está localizada em 1/5 ou 1/4 (contendo cerca de 118 resíduos de aminoácidos) da cadeia H próximo ao N-terminal e 1/2 (contendo cerca de 108-111 resíduos de aminoácidos) próximo ao N-terminal da cadeia L.Cada região V possui um anel peptídico formado por ligações dissulfeto intracadeia, e cada anel peptídico contém aproximadamente 67 a 75 resíduos de aminoácidos.A composição e o arranjo dos aminoácidos na região V determinam a especificidade de ligação ao antígeno do anticorpo.Devido aos tipos e sequências de aminoácidos em constante mudança na região V, muitos tipos de anticorpos com diferentes especificidades de antígenos de ligação podem ser formados.As regiões V da cadeia L e da cadeia H são chamadas de VL e VH, respectivamente.Em VL e VH, a composição de aminoácidos e a sequência de algumas regiões locais têm um maior grau de variação.Essas regiões são chamadas de regiões hipervariáveis (HVR).A composição de aminoácidos e o arranjo das partes não HVR na região V são relativamente conservadores, que é chamada de região estrutural.Existem três regiões hipervariáveis em VL, geralmente localizadas nos resíduos de aminoácidos 24 a 34 e 89 a 97, respectivamente.Os três HVRs de VL e VH são chamados de HVR1, HVR2 e HVR3, respectivamente.A pesquisa e análise da difração de cristal de raios X provou que a região hipervariável é de fato o local onde o antígeno do anticorpo se liga, por isso é chamada de região determinante de complementaridade (CDR).O HVR1, HVR2 e HVR3 de VL e VH podem ser chamados de CDR1, CDR2 e CDR3, respectivamente.Geralmente, CDR3 tem um maior grau de hipervariabilidade.A região hipervariável é também o principal local onde existem os determinantes idiotípicos das moléculas de Ig.Na maioria dos casos, a cadeia H desempenha um papel mais importante na ligação ao antígeno.
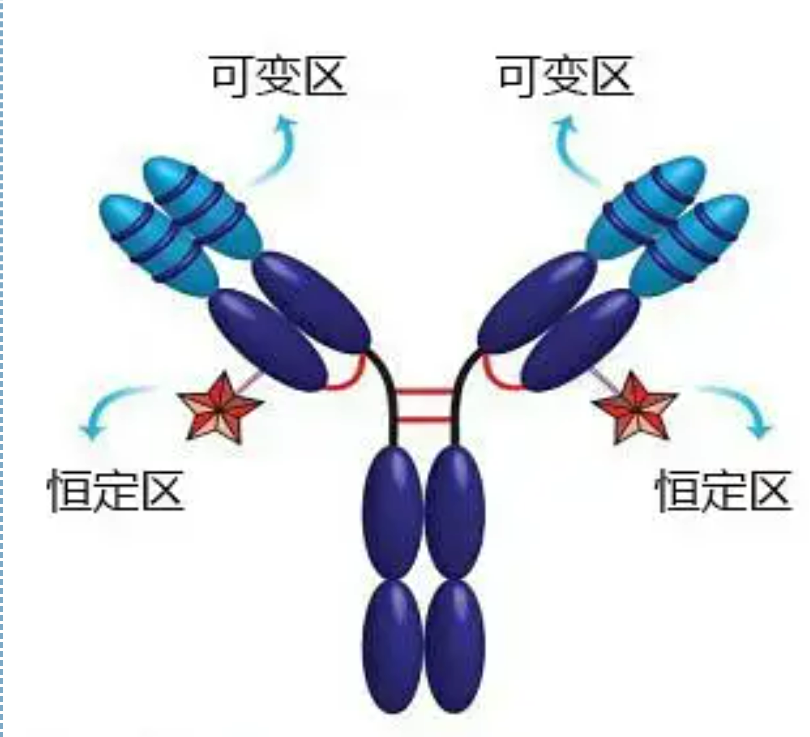 A região constante (região C)está localizado em 3/4 ou 4/5 (aproximadamente do aminoácido 119 ao terminal C) da cadeia H próximo ao terminal C e 1/2 (contém cerca de 105 resíduos de aminoácidos) próximo ao terminal C da cadeia L.Cada região funcional da cadeia H contém cerca de 110 resíduos de aminoácidos e contém um anel peptídico composto por 50-60 resíduos de aminoácidos conectados por pontes dissulfeto.A composição de aminoácidos e o arranjo desta região são relativamente constantes na mesma cadeia L de isotipo de Ig animal e na mesma cadeia de tipo H.O mesmo, só pode se ligar especificamente ao antígeno correspondente, mas a estrutura de sua região C é a mesma, ou seja, tem a mesma antigenicidade.O anticorpo secundário de cavalo anti-IgG humana (ou anti-anticorpo) pode ser combinado com os dois. Ocorre uma combinação de anticorpos (IgG) contra diferentes exotoxinas.Esta é uma base importante para a preparação de anticorpos secundários e aplicação de fluoresceína, isótopos, enzimas e outros anticorpos marcados.
A região constante (região C)está localizado em 3/4 ou 4/5 (aproximadamente do aminoácido 119 ao terminal C) da cadeia H próximo ao terminal C e 1/2 (contém cerca de 105 resíduos de aminoácidos) próximo ao terminal C da cadeia L.Cada região funcional da cadeia H contém cerca de 110 resíduos de aminoácidos e contém um anel peptídico composto por 50-60 resíduos de aminoácidos conectados por pontes dissulfeto.A composição de aminoácidos e o arranjo desta região são relativamente constantes na mesma cadeia L de isotipo de Ig animal e na mesma cadeia de tipo H.O mesmo, só pode se ligar especificamente ao antígeno correspondente, mas a estrutura de sua região C é a mesma, ou seja, tem a mesma antigenicidade.O anticorpo secundário de cavalo anti-IgG humana (ou anti-anticorpo) pode ser combinado com os dois. Ocorre uma combinação de anticorpos (IgG) contra diferentes exotoxinas.Esta é uma base importante para a preparação de anticorpos secundários e aplicação de fluoresceína, isótopos, enzimas e outros anticorpos marcados.
Produtos relacionados:
Kit Cell Direct RT-qPCR
Horário da postagem: 30 de setembro de 2021








