Ⅰ. Aumente a sensibilidade do sistema de reação:
1. Separe o RNA de alta qualidade:
A síntese bem-sucedida de cDNA vem de RNA de alta qualidade.O RNA de alta qualidade deve garantir pelo menos um total mais longo e não contém inibidores que não contenham enzimas de registro, como EDTA ou SDS.A qualidade do RNA determina o valor máximo da informação da sequência que você pode transcrever para o cDNA.O método geral de purificação de RNA é um método de etapas de uso de isocianato/acidofenol.Para evitar a poluição da RNase, o RNA separado de uma amostra rica em RNase (como o pâncreas) requer armazenamento de formaldeído para economizar RNA de alta qualidade, o que é ainda mais para armazenamento a longo prazo.O RNA extraído do fígado de rato foi basicamente degradado após uma semana de armazenamento em água, enquanto o RNA extraído do baço de rato permaneceu estável após três anos de armazenamento em água.Além disso, transcritos maiores que 4kb são mais sensíveis à degradação de traços de RNase do que transcritos pequenos.A fim de aumentar a estabilidade da amostra de RNA de armazenamento, o RNA pode ser dissolvido em uma metalamina de íon e armazenado a -70 °C.Thylide usado para salvar o RNA não deve conter um objeto diverso que degrade o RNA.O RNA, derivado do pâncreas, pode ser armazenado na metalamina por pelo menos um ano.Quando estiver pronto para usar o RNA, você pode usar os seguintes métodos para precipitar o RNA: adicionar NaCl a 0,2 m e 4 vezes o volume de etanol, colocar em temperatura ambiente por 3-5 minutos e centrifugar a 10.000 × g por 5 minutos.
2. Use transcriptase reversa sem atividade de RNaseH (RNaseH-):
Os inibidores de RNase são frequentemente adicionados a reações de transcrição reversa para aumentar o comprimento e o rendimento da síntese de cDNA.O inibidor de RNase é adicionado na primeira reação de síntese em cadeia na presença de tampões e agentes redutores, como DTT, porque o processo de síntese pré-cDNA desnatura o inibidor, liberando assim RNases ligadas que degradam o RNA.O inibidor da proteína RNase só previne a degradação do RNA pelas RNases A, B, C, e não previne RNases na pele, portanto deve-se tomar cuidado para não introduzir RNases dos dedos apesar do uso desses inibidores.
A transcriptase reversa catalisa a conversão de RNA em cDNA.Ambos M-MLV e AMV têm atividade RNaseH endógena, além de sua própria atividade de polimerase.A atividade de RNaseH compete com a atividade da polimerase por cadeias heterozigóticas formadas entre moldes de RNA e primers de DNA ou cadeias de extensão de cDNA e degrada RNA: cadeias de RNA em complexos de DNA.Moldes de RNA degradados pela atividade de RNaseH não podem mais ser usados como substratos efetivos para a síntese de cDNA, reduzindo o rendimento e o comprimento da síntese de cDNA.Assim, a eliminação ou grande redução da atividade de RNaseH da transcriptase reversa seria de grande benefício.
Transcriptase reversa SuperScriptⅡ, transcriptase reversa MMLV de RNaseH- e transcriptase reversa thermoScript, AMV de RNaseH- produziram mais cDNA completo do que MMLV e AMV.A sensibilidade do RT-PCR é afetada pela quantidade de cDNA sintetizado.O ThermoScript é muito mais sensível que o AMV.O tamanho dos produtos de RT-PCR é limitado pela capacidade da transcriptase reversa de sintetizar cDNA, especialmente ao clonar Cdnas maiores.Comparado com o MMLV, o SuperScripⅡ aumentou significativamente o rendimento de produtos longos de RT-PCR.A transcriptase reversa da RNaseH- também aumenta a estabilidade térmica, de modo que a reação pode ser realizada em temperaturas acima do normal de 37-42℃.Sob as condições de síntese sugeridas, oligo(dT) primers e 10μCi [alpha-p]dCTP foram usados.A produção total da primeira cadeia foi calculada usando o método de precipitação TCA.O cDNA completo foi analisado usando remoção de tiras classificadas por tamanho e contagem em um gel de agarose alcalino.
3. Aumente a temperatura de preservação de calor da transcrição reversa:
Uma temperatura de retenção mais alta ajuda a abrir a estrutura secundária do RNA e aumentar o rendimento da reação.Para a maioria dos moldes de RNA, manter o RNA e o primer a 65°C sem tampão ou sal e resfriá-los rapidamente no gelo elimina a maioria das estruturas secundárias e permite que os primers se liguem.No entanto, alguns moldes ainda apresentam estrutura secundária, mesmo após a desnaturação térmica.A amplificação desses modelos difíceis pode ser realizada usando a transcriptase reversa ThermoScript e colocando a reação da transcriptase reversa em temperaturas mais altas para melhorar a amplificação.Temperaturas de manutenção mais altas também podem aumentar a especificidade, especialmente quando a síntese de cDNA é realizada usando primers específicos de gene (GSPS) (consulte o Capítulo 3).Se estiver usando GSP, certifique-se de que o valor de Tm do primer seja o mesmo que a temperatura de retenção esperada.Não use oligo(dT) e primers aleatórios acima de 60℃.Os primers aleatórios precisam ser mantidos a 25 ℃ por 10 minutos antes de aumentar para 60 ℃.Além de usar temperaturas de transcrição reversa mais altas, a especificidade pode ser melhorada transferindo diretamente a mistura de RNA/iniciador da temperatura de desnaturação de 65 ℃ para a temperatura de manutenção da transcrição reversa e adicionando uma mistura de reação 2 × pré-aquecida (síntese de iniciação térmica de cDNA).Essa abordagem ajuda a evitar o pareamento de bases intermoleculares que ocorre em temperaturas mais baixas.O uso de um instrumento de PCR simplifica os muitos interruptores de temperatura necessários para RT-PCR.
A polimerase termicamente estabilizada atua como DNA polimerase na presença de Mg2+ e RNA polimerase na presença de Mn2+.Ele pode manter o calor em até 65 ℃.No entanto, a presença de Mn2+ durante a PCR reduz a fidelidade, o que torna a Tth polimerase menos adequada para amplificação de alta precisão, como a clonagem de cDNA.Além disso, Tth é menos eficiente na transcrição reversa, o que reduz a sensibilidade, e como uma única enzima pode realizar transcrição reversa e PCR, reações de controle sem transcrição reversa não podem ser usadas para distinguir produtos amplificados de cDNA daqueles de DNA genômico contaminado.
4. Aditivo que promove a transcrição reversa:
A adição de aditivos, incluindo glicerina e DMSO, à primeira reação de síntese em cadeia pode reduzir a estabilidade da fita dupla do ácido nucléico e desenrolar a estrutura secundária do RNA.Até 20% de glicerina ou 10% de DMSO podem ser adicionados sem afetar a atividade do SuperScriptⅡ ou MMLV.O AMV também pode tolerar até 20% de glicerol sem reduzir a atividade.Para maximizar a sensibilidade do RT-PCR na reação de transcrição reversa SuperScriptⅡ, 10% de glicerol pode ser adicionado e isolado a 45℃.Se 1/10 do produto da reação de retrotranscrição for adicionado à PCR, a concentração de glicerol na reação de amplificação é de 0,4%, o que não é suficiente para inibir a PCR.
5. Processamento de RNaseH:
A sensibilidade pode ser melhorada tratando as reações de síntese de cDNA com RNaseH antes da PCR.Para alguns modelos, acredita-se que o RNA na reação de síntese de cDNA impeça a ligação de produtos amplificados, caso em que o tratamento com RNaseH pode aumentar a sensibilidade.Geralmente, o tratamento com RNaseH é necessário para a amplificação de um modelo alvo de cDNA de comprimento total relativamente longo, como escherose tuberosaⅡ com baixa cópia.Para este modelo difícil, RNaseH melhorou o sinal gerado pelo cDNA sintetizado por SuperScriptⅡ ou AMV.Para a maioria das reações de RT-PCR, o tratamento RNaseH é opcional porque a etapa de desnaturação de PCR isolada a 95 ℃ normalmente hidrolisa o RNA do complexo RNA: DNA.
6. Métodos aprimorados para detectar pequenas quantidades de RNA:
RT-PCR é particularmente desafiador quando apenas pequenas quantidades de RNA estão disponíveis.A adição de glicogênio como transportador durante a separação do RNA ajuda a aumentar o rendimento de pequenas amostras.Um glicogênio livre de RNase pode ser adicionado ao mesmo tempo que o Trizol.O glicogênio é solúvel em água e pode permanecer na fase aquosa com o RNA para auxiliar na precipitação subsequente.A concentração recomendada de glicogênio livre de RNase é de 250μg/ml para amostras com menos de 50mg de tecido ou 106 células cultivadas.
A adição de BSA acetilado para reações de transcrição reversa usando SuperScriptⅡ pode aumentar a sensibilidade, e para pequenas quantidades de RNA, reduzindo a quantidade de SuperScriptⅡ e adicionando 40 unidades de inibidor de nuclease RnaseOut pode melhorar o nível de detecção.Se o glicogênio for usado na separação de RNA, a adição de inibidores de BSA ou RNase para reações de transcrição reversa usando SuperScriptⅡ ainda é recomendada.
Ⅱ. Aumentar a especificidade do RT-PCR
1. Síntese de cNDA:
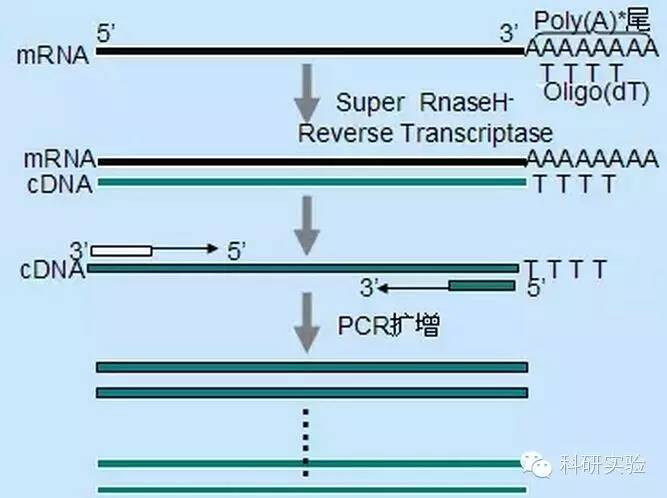
Três métodos diferentes podem ser usados para iniciar a síntese da primeira fita de cDNA, e a especificidade relativa de cada método afeta a quantidade e o tipo de cDNA sintetizado.
O método do primer aleatório é o menos específico dos três métodos.Os primers são recozidos em vários locais ao longo da transcrição para produzir cDNA curto e de comprimento parcial.Este método é frequentemente usado para obter sequências terminais 5' e cDNA de moldes de RNA com regiões estruturais secundárias ou com sítios de terminação que a transcriptase reversa não pode replicar.Para obter o cDNA mais longo, a proporção de primers para RNA em cada amostra de RNA precisa ser determinada empiricamente.A concentração inicial de primers aleatórios varia de 50 a 250ng por sistema de reação de 20μl.Como o cDNA sintetizado a partir do RNA total usando primers aleatórios é principalmente RNA ribossômico, poli(A)+RNA é geralmente selecionado como molde.
A iniciação de oligo(dT) é mais específica do que iniciadores aleatórios.Ele hibridiza com a cauda poli(A) encontrada na extremidade 3' do mRNA na maioria das células eucarióticas.Como o poli(A)+RNA é aproximadamente 1% a 2% do RNA total, a quantidade e a complexidade do cDNA são muito menores do que se fossem usados primers aleatórios.Devido à sua alta especificidade, o oligo(dT) geralmente não requer otimização para a proporção de RNA para primer e seleção de poli(A)+.Recomenda-se usar 0,5μg de oligo(dT) por sistema de reação de 20μl.oligo(dT)12-18 é adequado para a maioria dos RT-PCR.O sistema ThermoScript RT-PCR fornece oligo(dT)20 devido à sua boa estabilidade térmica e é adequado para temperaturas de retenção mais altas.
Os primers específicos do gene (GSP) são os melhores primers específicos para a etapa de transcrição reversa.GSP é um oligonucleosídeo antisense que pode hibridizar especificamente com sequências de destino de RNA, em vez de emparelhar todos os Rnas como iniciadores aleatórios ou oligo(dT).As regras usadas para projetar primers de PCR também se aplicam ao projeto de reação de transcrição reversa GSP.GSP pode ser a mesma sequência que o iniciador de amplificação emparelhado no final do mRNA3', ou GSP pode ser projetado para ser emparelhado a jusante com o iniciador de amplificação reversa.Para alguns objetos amplificados, é necessário projetar mais de um primer antisense para RT-PCR bem-sucedido porque a estrutura secundária do RNA alvo pode impedir a ligação do primer.Sugere-se a utilização de 1 pmol de GSP antisense no primeiro sistema de reação de síntese em cadeia de 20μl.
2. Aumente a temperatura de preservação de calor da transcrição reversa:
Para aproveitar ao máximo a especificidade do GSP, deve ser usada a transcriptase reversa com alta estabilidade térmica.A transcriptase reversa estável ao calor pode ser isolada em temperaturas mais altas para aumentar o rigor da reação.Por exemplo, se um GSP for recozido a 55°C, a especificidade do GSP não será totalmente utilizada se a transcrição reversa for realizada a 37°C com baixo rigor usando AMV ou M-MLV.No entanto, SuperScripⅡ e ThermoScript podem reagir a 50℃ ou mais, o que elimina produtos inespecíficos produzidos em temperaturas mais baixas.Para especificidade máxima, a mistura de RNA/iniciador pode ser transferida diretamente da temperatura de desnaturação de 65 ℃ para a temperatura de manutenção da transcrição reversa com a adição de uma mistura de reação 2 x pré-aquecida (iniciação térmica da síntese de cDNA).Isso ajuda a evitar o pareamento de bases entre as moléculas em baixas temperaturas.O uso de um instrumento de PCR simplifica as muitas transições de temperatura necessárias para RT-PCR.
3. Reduzir a contaminação do DNA genômico:
Uma dificuldade potencial com RT-PCR é que o RNA contamina o DNA genômico.O uso de melhores métodos de separação de RNA, como Trizol Reagent, reduz a contaminação de DNA genômico em preparações de RNA.Para evitar produtos produzidos a partir do DNA genômico, o RNA pode ser tratado com grau de amplificação DnasⅠ para remover o DNA contaminado antes da transcrição reversa.As amostras foram mantidas a 65 ℃ em 2,0 mM EDTA por 10 min para terminar a digestão de DNaseⅠ.O EDTA quela íons de magnésio para evitar a hidrólise do RNA dependente de íons de magnésio que ocorre em altas temperaturas.
Para separar o cDNA amplificado do produto de amplificação do DNA do genoma, podem ser projetados primers que se unem separadamente com o éxon separado.Os produtos de PCR derivados do cDNA serão mais curtos do que os derivados do DNA genômico contaminado.Um experimento controlado sem transcrição reversa também é realizado em cada modelo de RNA para determinar se um determinado fragmento é de DNA genômico ou cDNA.Os produtos de PCR obtidos na ausência de transcrição reversa são derivados do genoma.
Produto relacionado
-O kit de uma etapa permite que a transcrição reversa e a PCR sejam realizadas no mesmo tubo.Ele só precisa adicionar RNA modelo, primers de PCR específicos e ddH livre de RNase2O.
-A análise quantitativa em tempo real do RNA pode ser realizada com rapidez e precisão.
-O kit usa um reagente exclusivo de transcrição reversa Foregene e Foregene HotStar Taq DNA Polymerase combinado com um sistema de reação exclusivo para melhorar efetivamente a eficiência de amplificação e a especificidade da reação.
-O sistema de reação otimizado faz com que a reação tenha maior sensibilidade de detecção, estabilidade térmica mais forte e melhor tolerância.
-Capacidade eficiente de remover gDNA, que pode remover gDNA no modelo em 2 minutos.
-Eficiente sistema de transcrição reversa, leva apenas 15 minutos para completar a síntese da primeira fita de cDNA.
-Modelos complexos: modelos com alto conteúdo de GC e estrutura secundária complexa também podem ser revertidos com alta eficiência.
-Sistema de transcrição reversa de alta sensibilidade, os modelos de nível pg também podem obter cDNA de alta qualidade.
-O sistema de transcrição reversa tem alta estabilidade térmica, a temperatura de reação ideal é de 42 ℃ e ainda possui bom desempenho de transcrição reversa a 50 ℃.
Horário de postagem: Mar-07-2023